Os ácidos podem ser classificados segundo vários critérios, vejamos:
Presença de oxigênio:
1. Hidrácidos – ácidos que não possuem oxigênio.
Exemplos: HI (ácido iodídrico), HCl (ácido clorídrico), HCN (ácido cianídrico).
2. Oxiácidos – ácidos que possuem oxigênio.
Ex: HNO3 (ácido nítrico), H2SO4 (ácido sulfúrico), H3PO4 (ácido fosfórico).
Volatilidade:
- Ácidos Voláteis – apresentam tendência à evaporação.
Exemplos: CH3COOH (ácido acético), HF (ácido fluorídrico), Hidrácidos em geral.
O vinagre (ácido acético) é um exemplo de ácido altamente volátil, quando abrimos um recipiente que o contém logo sentimos seu odor característico.
- Ácidos Fixos – apresentam pequena tendência à evaporação.
Exemplos: H2SO4 (ácido sulfúrico), H3PO4 (ácido fosfórico). Os Oxiácidos em geral não são voláteis.
Número de hidrogênios ionizáveis:
Essa classificação diz respeito à ionização de hidrogênios (H) presentes em ácidos. O número de H ionizável será a mesma quantidade de átomos de H na molécula.
• Monoácidos: possuem um único átomo de hidrogênio por molécula, portanto, apenas 1 "H" ionizável.
Exemplos: HCl (ácido clorídrico), HClO4 (ácido perclórico).
• Diácidos: possuem 2 "H" ionizáveis.
Exemplos: H2CrO4 (ácido crômico), H2CO3 (ácido carbônico).
• Triácidos: possuem 3 "H" ionizáveis.
Exemplos: H3SbO4 (ácido antimônico), H3AsO4 (ácido arsênico), H3[Fe(CN)] – ácido ferricianídrico.
• Tetrácidos: possuem 4 "H" ionizáveis.
Exemplo: H4P2O7 (ácido pirosfórico)
Bem-vindos ao mais atualizado e inovador blog de aprendizado.Confira e aprenda de um modo dinâmico e divertido a mais temerosa QUÍMICA.
Total de visualizações de página
terça-feira, 26 de novembro de 2013
segunda-feira, 25 de novembro de 2013
Ácido acético
O ácido acético é um líquido incolor de cheiro irritante e penetrante e sabor azedo, que é quimicamente denominado de ácido etanoico e sua fórmula estrutural está demonstrada a seguir:
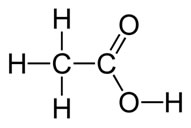


Veja que ele é um composto que pertence ao grupo orgânico dos ácidos carboxílicos.
Ele é o principal constituinte do vinagre, que é uma solução aquosa de 4 a 10% em massa de ácido acético. Ele foi obtido pela primeira vez por meio do etanol do vinho, que se oxida com o oxigênio presente no ar. Daí a origem do seu nome, pois vinho azedo vem do latim acetum que significa “vinagre”.
O uso desse composto é muito antigo, inclusive, as legiões romanas que conquistaram grande parte do mundo, conhecidas no século III a.C., marchavam longas distâncias e levavam consigo um frasco contendo vinho azedo diluído. Essa mistura de ácido acético estimulava a salivação dos soldados e diminuía a sensação de sede.

Hoje em dia, a indústria costuma usar o mesmo princípio, isto é, a oxidação do etanol (álcool etílico), para se produzir esse ácido:
H3C ─ CH2 ─ OH + O2 (ar) → H3C ─ COOH + H2O
Etanol oxigênio ácido acético ou etanoico água
Etanol oxigênio ácido acético ou etanoico água
No caso do vinagre, essa oxidação mostrada na reação química acima é obtida por meio de fermentação, com o auxílio do fungo Mycoderma aceti (chamado mãe do vinagre) e da enzima alcooloxidase. Podem-se usar também bactérias do gênero Acetobacter e Clostridium acetobtylicum. Porém, outro meio é o uso de um catalisador como o pentóxido de divanádio (V2O5).
Pode-se também produzir o ácido acético por meio da oxidação do metanol, pela destilação da madeira e a partir de derivados do petróleo.
Além de ser usado como tempero na alimentação, o acido acético também é usado na produção de acetato de vinila (para se fazer o polímero PVA), de anidrido acético e cloreto de acetila (usados em sínteses orgânicas), de ésteres (solventes, perfumes, essências, entre outros), de acetato de celulose (fibras têxteis), de acetatos inorgânicos etc.
Quando está na sua forma pura é chamado de ácido acético glacial, pois se solidifica a temperatura de 16,7ºC, ficando com o aspecto de gelo.
sexta-feira, 22 de novembro de 2013
A vitamina do banho de sol!!!!
O sol é taxado como um vilão para a saúde e de fato é perigoso, quando tem ação prolongada sobre a pele pode levar ao temido câncer de pele. O que não se pode confundir é um Banho de sol de qualidade com uma insolação.
O que mais se ouve por aí é que para manter a saúde corporal é preciso manter uma dieta balanceada, fazer muito exercício físico, ingerir somente alimentos saudáveis, todos estes requisitos fazem parte do processo, mas não são suficientes para se alcançar a vitalidade. Pelo contrário, o que estamos sugerindo neste contexto não diz respeito a sacrifício algum, como passar fome, resistir a doces, ficar exausto de malhar, bastariam apenas 15 minutos diários de uma prazerosa tarefa: vestir uma roupa de banho e curtir o sol a beira de uma piscina!
Mas o que tem de tão especial nesta ação? Trata-se da vitamina presente nos raios solares que está envolvida em diversas funções corporais, como a atividade imunológica, fortalecimento de ossos, desenvolvimento embrionário, inibidor de câncer, entre outras. Estamos falando da vitamina D, ela se faz presente também em alimentos como o salmão, por exemplo, nesta forma fica difícil seu consumo, já que ninguém come este peixe todo dia. Mas no caso do sol, a vitamina é gratuita e está disponível diariamente para quem quiser.
A seguir, como é ativada a vitamina D no organismo:
As partículas de colesterol presentes nos alimentos que ingerimos são usadas para fabricar o composto 7- dehidrocolesterol, uma vez presente em nosso organismo este composto se desloca para a camada externa de nossa pele (a epiderme). Ao recebermos a radiação solar, mais precisamente os raios ultravioletas do tipo B (UVB) que penetram na pele, a molécula de 7- dehidrocolesterol passa por várias transformações químicas e dá origem à vitamina D.
Para o tempo não ser uma desculpa para se isentar da vitamina D, procure realizar tarefas diárias, como ler o Jornal sentado ao sol. A roupa de banho é ideal, porque o recomendável seria deixar cerca de 30 % do corpo exposto, só não se esqueça do protetor solar.
Não dificulte a sua longevidade, divirta-se no verão: tome aquele sol vitaminado! Invista em sua saúde além de manter aquele maravilhoso bronzeado dourado.
O que mais se ouve por aí é que para manter a saúde corporal é preciso manter uma dieta balanceada, fazer muito exercício físico, ingerir somente alimentos saudáveis, todos estes requisitos fazem parte do processo, mas não são suficientes para se alcançar a vitalidade. Pelo contrário, o que estamos sugerindo neste contexto não diz respeito a sacrifício algum, como passar fome, resistir a doces, ficar exausto de malhar, bastariam apenas 15 minutos diários de uma prazerosa tarefa: vestir uma roupa de banho e curtir o sol a beira de uma piscina!
Mas o que tem de tão especial nesta ação? Trata-se da vitamina presente nos raios solares que está envolvida em diversas funções corporais, como a atividade imunológica, fortalecimento de ossos, desenvolvimento embrionário, inibidor de câncer, entre outras. Estamos falando da vitamina D, ela se faz presente também em alimentos como o salmão, por exemplo, nesta forma fica difícil seu consumo, já que ninguém come este peixe todo dia. Mas no caso do sol, a vitamina é gratuita e está disponível diariamente para quem quiser.
A seguir, como é ativada a vitamina D no organismo:
As partículas de colesterol presentes nos alimentos que ingerimos são usadas para fabricar o composto 7- dehidrocolesterol, uma vez presente em nosso organismo este composto se desloca para a camada externa de nossa pele (a epiderme). Ao recebermos a radiação solar, mais precisamente os raios ultravioletas do tipo B (UVB) que penetram na pele, a molécula de 7- dehidrocolesterol passa por várias transformações químicas e dá origem à vitamina D.
Para o tempo não ser uma desculpa para se isentar da vitamina D, procure realizar tarefas diárias, como ler o Jornal sentado ao sol. A roupa de banho é ideal, porque o recomendável seria deixar cerca de 30 % do corpo exposto, só não se esqueça do protetor solar.
Não dificulte a sua longevidade, divirta-se no verão: tome aquele sol vitaminado! Invista em sua saúde além de manter aquele maravilhoso bronzeado dourado.
quinta-feira, 21 de novembro de 2013
A química do amor!!!
Você já ouviu esta frase: Rolou uma química entre nós! Será que existe mesmo uma explicação científica para o amor?
O sentimento não afeta só o nosso ego de forma figurada, mas está presente de forma mais concreta, produz reações visíveis em nosso corpo inteiro. Se não fosse assim como explicar as mãos suando, coração acelerado, respiração pesada, olhar perdido (tipo "peixe morto"), o ficar rubro quando se está perto do ser amado?
Afinal, o amor tem algo a ver com a Química? Na verdade O AMOR É QUÍMICA! Todos os sintomas relatados acima têm uma explicação científica: são causados por um fluxo de substâncias químicas fabricadas no corpo da pessoa apaixonada. Entre essas substâncias estão: adrenalina, noradrenalina, feniletilamina, dopamina, oxitocina, a serotonina e as endorfinas. Viu como são necessários vários hormônios para sentir aquela sensação maravilhosa quando se está amando?
A dopamina produz a sensação de felicidade, a adrenalina causa a aceleração do coração e a excitação. A noradrenalina é o hormônio responsável pelo desejo sexual entre um casal, nesse estágio é que se diz que existe uma verdadeira química, pois os corpos se misturam como elementos em uma reação química.
Mas acontece que essa sensação pode não durar muito tempo, neste ponto os casais têm a impressão que o amor esfriou. Com o passar do tempo o organismo vai se acostumando e adquirindo resistência, passa a necessitar de doses cada vez maiores de substâncias químicas para provocar as mesmas sensações do início. É aí que entra os hormônios ocitocina e vasopressina, são eles os responsáveis pela atração que evolui para uma relação calma, duradoura e segura, afinal, o amor é eterno!
O sentimento não afeta só o nosso ego de forma figurada, mas está presente de forma mais concreta, produz reações visíveis em nosso corpo inteiro. Se não fosse assim como explicar as mãos suando, coração acelerado, respiração pesada, olhar perdido (tipo "peixe morto"), o ficar rubro quando se está perto do ser amado?
Afinal, o amor tem algo a ver com a Química? Na verdade O AMOR É QUÍMICA! Todos os sintomas relatados acima têm uma explicação científica: são causados por um fluxo de substâncias químicas fabricadas no corpo da pessoa apaixonada. Entre essas substâncias estão: adrenalina, noradrenalina, feniletilamina, dopamina, oxitocina, a serotonina e as endorfinas. Viu como são necessários vários hormônios para sentir aquela sensação maravilhosa quando se está amando?
A dopamina produz a sensação de felicidade, a adrenalina causa a aceleração do coração e a excitação. A noradrenalina é o hormônio responsável pelo desejo sexual entre um casal, nesse estágio é que se diz que existe uma verdadeira química, pois os corpos se misturam como elementos em uma reação química.
Mas acontece que essa sensação pode não durar muito tempo, neste ponto os casais têm a impressão que o amor esfriou. Com o passar do tempo o organismo vai se acostumando e adquirindo resistência, passa a necessitar de doses cada vez maiores de substâncias químicas para provocar as mesmas sensações do início. É aí que entra os hormônios ocitocina e vasopressina, são eles os responsáveis pela atração que evolui para uma relação calma, duradoura e segura, afinal, o amor é eterno!
quarta-feira, 20 de novembro de 2013
A poluição prejudica o desempenho dos atletas?
Esta questão foi levantada justamente por que os Jogos Olímpicos de 2008 terão como sede uma das capitais mais poluídas do mundo. Para se ter uma ideia, a cidade de São Paulo é a 3ª cidade mais poluída da América Latina, mas os atletas conseguem praticar seus esportes tranquilamente. O grande problema é que em Pequim a poluição é três vezes maior do que na capital Paulista. Os chineses estão investindo muito para contornar a situação, já foram gastos mais de 17 bilhões de dólares, e mesmo assim o Comitê Olímpico Internacional já admitiu que não se pode esperar novos recordes ao ar livre, devido à contaminação atmosférica.
A poluição com certeza vai afetar o desempenho dos atletas, é só fazer a seguinte análise: um atleta respira cerca de 20 vezes mais ar que uma pessoa comum, e na cidade de Pequim significa inspirar 4 vezes mais CO (monóxido de carbono), CO2 (dióxido de carbono e ozônio do que o corpo tolera.
O ar poluído pode gerar de cãibras a infarto, veja abaixo as consequências da poluição no organismo humano:
- O dióxido de carbono quando chega à alta concentração aos pulmões, atrapalha o trabalho das hemácias. As hemácias são as células responsáveis por levar oxigênio ao organismo.
- O monóxido de carbono rouba o lugar do oxigênio nas hemácias, os músculos podem então sofrer cãibras por falta de força. A ausência de oxigênio no cérebro causa tonturas e pode levar até mesmo ao coma.
- O ozônio prejudica a corrente sanguínea, ele possui a propriedade de converter colesterol em placas de gordura, estas grudam nos vasos sanguíneos e diminuem a flexibilidade dos mesmos. O coração passa a trabalhar sob alta pressão para continuar bombeando sangue, e isto pode causar hemorragias e infarto.
A poluição com certeza vai afetar o desempenho dos atletas, é só fazer a seguinte análise: um atleta respira cerca de 20 vezes mais ar que uma pessoa comum, e na cidade de Pequim significa inspirar 4 vezes mais CO (monóxido de carbono), CO2 (dióxido de carbono e ozônio do que o corpo tolera.
O ar poluído pode gerar de cãibras a infarto, veja abaixo as consequências da poluição no organismo humano:
- O dióxido de carbono quando chega à alta concentração aos pulmões, atrapalha o trabalho das hemácias. As hemácias são as células responsáveis por levar oxigênio ao organismo.
- O monóxido de carbono rouba o lugar do oxigênio nas hemácias, os músculos podem então sofrer cãibras por falta de força. A ausência de oxigênio no cérebro causa tonturas e pode levar até mesmo ao coma.
- O ozônio prejudica a corrente sanguínea, ele possui a propriedade de converter colesterol em placas de gordura, estas grudam nos vasos sanguíneos e diminuem a flexibilidade dos mesmos. O coração passa a trabalhar sob alta pressão para continuar bombeando sangue, e isto pode causar hemorragias e infarto.
terça-feira, 19 de novembro de 2013
Momento de rir!!!!
P: 2 ursos são jogados na água mas só um dissolve, porque?
R: Porque ele era um urso polar!
P: O que seis carbonos estão fazendo de mãos dadas com seis hidrogênios na igreja?
R: Benzeno!
P: Porque o martelo e a tesoura são hidrocarbonetos?
R: Porque o martelo é propino e a tesoura é propano!
R: Porque ele era um urso polar!
P: O que seis carbonos estão fazendo de mãos dadas com seis hidrogênios na igreja?
R: Benzeno!
P: Porque o martelo e a tesoura são hidrocarbonetos?
R: Porque o martelo é propino e a tesoura é propano!
segunda-feira, 18 de novembro de 2013
sábado, 16 de novembro de 2013
PROFISSÃO QUIMICO
Alunos de Ensino Médio em geral têm muitas dúvidas sobre as profissões,
afinal, eles precisam optar por uma delas para prestar vestibular e se
profissionalizar em uma área específica e quem sabe fazer mestrado,
doutorado, etc. Para a carreira profissional ser um sucesso, antes mesmo
de iniciá-la é preciso conhecer profundamente sobre seus aspectos para
que, no futuro, a carreira escolhida não seja motivo de arrependimento.
Neste contexto vamos tratar da Profissão de Químico, o professor da disciplina de Química poderá aproveitar o esclarecimento e aplicar alguns conceitos sobre seu conteúdo em sala de aula.
O que o Químico faz?
O químico em seu exercício profissional colabora para a melhoria da qualidade de vida, suas pesquisas desenvolvem produtos que usamos diariamente. O profissional atua em várias áreas, dentre elas a de biocombustíveis, conservação de alimentos industrializados, obtenção de cosméticos, entre outras.
O químico trabalha através da análise das substâncias, identificando suas propriedades, aplicações, características físico-químicas, etc.
Ao final da aula, aqueles que estavam com dúvidas sobre o profissional devem tê-las esclarecido, e aqueles que apresentarem a predisposição de seguir a carreira de Químico devem ter total apoio do professor. Esta aula pode ser definitiva na vida do aluno, através dela ele poderá fazer uma escolha para seu futuro, sendo assim, a maneira como a profissão foi apresentada constitui fator decisório.
Existem inúmeros relatos de alunos que se decidiram pela vida profissional pela motivação que seus professores transmitiam em sala de aula. Por exemplo: um ótimo professor de Português, que se sente realizado profissionalmente, exerce uma grande influência para que seus alunos sigam a mesma carreira escolhida por ele.
O professor ficará gratificado se ao final da aula os alunos chegarem à seguinte conclusão: A Química é uma ciência apaixonante!
Por Líria Alves
Graduada em Química
Equipe Brasil Escola
Neste contexto vamos tratar da Profissão de Químico, o professor da disciplina de Química poderá aproveitar o esclarecimento e aplicar alguns conceitos sobre seu conteúdo em sala de aula.
O que o Químico faz?
O químico em seu exercício profissional colabora para a melhoria da qualidade de vida, suas pesquisas desenvolvem produtos que usamos diariamente. O profissional atua em várias áreas, dentre elas a de biocombustíveis, conservação de alimentos industrializados, obtenção de cosméticos, entre outras.
O químico trabalha através da análise das substâncias, identificando suas propriedades, aplicações, características físico-químicas, etc.
Ao final da aula, aqueles que estavam com dúvidas sobre o profissional devem tê-las esclarecido, e aqueles que apresentarem a predisposição de seguir a carreira de Químico devem ter total apoio do professor. Esta aula pode ser definitiva na vida do aluno, através dela ele poderá fazer uma escolha para seu futuro, sendo assim, a maneira como a profissão foi apresentada constitui fator decisório.
Existem inúmeros relatos de alunos que se decidiram pela vida profissional pela motivação que seus professores transmitiam em sala de aula. Por exemplo: um ótimo professor de Português, que se sente realizado profissionalmente, exerce uma grande influência para que seus alunos sigam a mesma carreira escolhida por ele.
O professor ficará gratificado se ao final da aula os alunos chegarem à seguinte conclusão: A Química é uma ciência apaixonante!
Por Líria Alves
Graduada em Química
Equipe Brasil Escola
sexta-feira, 15 de novembro de 2013
quinta-feira, 14 de novembro de 2013
quarta-feira, 13 de novembro de 2013
A QUIMICA DO FOGO DE ARTIFICIO
Alguns materiais podem emitir luz quando excitados. Isso ocorre quando os elétrons dos átomos absorvem energia e passam para níveis externos (maior energia), e ao retornar para os níveis de origem (menor energia), liberam a energia absorvida na forma de um fóton de luz. Temos então a luminescência, como o fenômeno é chamado.
A luminescência é usada, por exemplo, na produção dos fogos de artifício. Para entender a química presente nestes dispositivos precisamos entender um pouco da estrutura dos mesmos.
Os foguetes contêm um cartucho de papel no formato de cilindro recheado de carga explosiva. Esta carga diz respeito ao propelente, o responsável por disparar os fogos.
A pólvora negra é um dos propelentes mais utilizados, possui em sua composição uma mistura de salitre (nitrato de potássio), enxofre e carvão. Perclorato de potássio (KCLO4) também pode ser usado como propelente.
Para deixar os fogos de artifício coloridos, os fabricantes misturam à pólvora sais de diferentes elementos para que, quando detonados, produzam cores diferentes. Agora você já sabe dos segredos que compõem a linda explosão de cores admirada em momentos especiais, como por exemplo, nas festas de Réveillon.
Vejamos alguns dos compostos responsáveis pela coloração dos fogos:
Laranja: os sais de cálcio são responsáveis por esta coloração em foguetes.
Vermelho: a cor rubra surge da queima de sais de Estrôncio ou carbonato de Lítio.
Amarelo: obtido pela queima de Sódio.
Prata: o espetáculo da “chuva de Prata” é produzido pela queima de pó de titânio, de alumínio ou magnésio.
Dourado: o metal ferro presente nos fogos de artifício confere o tom de Ouro.
Azul: o aquecimento do metal cobre nos faz visualizar a cor azul.
Roxo: a mistura de Estrôncio e Cobre dá origem a essa bela cor.
Verde: a queima de Bário faz surgir o verde incandescente.
terça-feira, 12 de novembro de 2013
Curiosidades: As bases no cotidiano
Bases são substâncias que, em solução aquosa sofrem dissociação liberando o ânion OH- (Hidroxila). Quando fundidos ou em solução aquosa podem conduzir corrente elétrica, as bases fortes nesse meio originam muitos íons, assim conduzindo bem a corrente elétrica, já as fracas conduzem pouca eletricidade.
No cotidiano encontramos alimentos alcalinos (base), por exemplo, o leite, tomate, legumes, frutas entre outros nutrientes, a digestão desses alimentos auxilia no controle e equilíbrio acidobásico em nosso organismo.
Encontramos também as bases nos produtos de higiene doméstica, como o detergente, alvejantes, sabões entre outros. No entanto substâncias básicas podem ser perigosas, como o hidróxido de sódio.
Uma base é considerada forte ou fraca de acordo com o seu grau de dissociação (α). Bases fortes são as que dissociam muito, aproximadamente 100%, mas se o valor for menor ou igual a 5% a base é considerada fraca.
mundo-da-quimica-bases
Exemplos de bases fortes e fracas:
Bases fortes: Bases dos metais alcalinos (Na (OH)2, KOH, CsOH) e de alguns metais alcalinos-terrosos ( Ba(OH)2, Ca(OH)2).
Obs.: O Hidróxido de magnésio (Mg(OH)2) é uma exceção, sendo uma base fraca.
Bases fracas: O hidróxido de amônio (NH4OH) e as bases dos demais metais (das famílias 13,14 e 15).
Bases que encontramos no dia-a-dia:
O hidróxido de amônio (NH4OH)
É uma solução de amônia ou amoníaco, uma de suas utilizações é para descolorir cabelos.
A amônia (NH3) é um gás incolor de odor forte, ela também é usada na fabricação de sais de amônio que é utilizado como fertilização na agricultura, e na fabricação de produtos de limpeza doméstica.
Hidróxido de sódio ou soda cáustica (NaOH)
É a base mais importante e utilizada na indústria e no laboratório, assim como na fabricação de sabão, papel, corantes entre outros produtos. A soda cáustica é corrosiva por isso deveremos manuseá-la com muito cuidado.
segunda-feira, 11 de novembro de 2013
A Química do Champagne
É difícil imaginar uma comemoração especial e principalmente Ano Novo sem um brinde com um espumante. Muitos se habituaram a chamar espumantes de Champagne, mas nem todos são. O Champagne é o vinho espumante feito exclusivamente na região de Champagne, na França, é necessário que o vinho respeite regras bem definidas para ter esta denominação. Fora desta região, eles são chamados de espumantes ou de outros nomes.
O que é um espumante?
É nome genérico para todo vinho que passa por duas fermentações, produzindo etanol(CH3-CH2-OH) e dióxido de carbono(CO2).
Ele pode conter mais de 600 compostos químicos diferentes.
Como ocorre essas fermentações?
A primeira fermentação é a alcoólica, reação química que transforma os açúcares da uva em álcool.
A segunda acontece quando são adicionados açúcares e leveduras, da qual resulta o dióxido de carbono, que se dissolve no líquido.
Esta bebida obedece à Lei de Henry (A solubilidade de um gás dissolvido em um líquido é proporcional à pressão parcial do gás acima do líquido), ou seja, em uma garrafa fechada de champagne, o dióxido de carbono dissolvido no vinho está em equilíbrio com o gás entre a rolha e o líquido.
Ao abrir a garrafa o equilíbrio se desfaz, a pressão do gás acima do líquido diminui e a concentração do dióxido de carbono na bebida também diminui, formando as borbulhas.
Algumas dicas
- Nunca colocar espumantes no congelador, a pressão dentro da garrafa pode fazer com que ela exploda, o correto é colocar a bebida em um balde de gelo com água durante 30 a 40 minutos, para que a temperatura seja distribuída uniformemente.
Espumante
- Inclinar o copo para servir a bebida pode preservar o dobro do dióxido de carbono.
- Ao servir garrafa deve estar bem fria e não ter sido chacoalhada, ao contrário, mais gás dissolve no líquido aumentando a pressão e ao abri-la o liquido é liberado na forma de um jorro de espuma.
sexta-feira, 8 de novembro de 2013
quinta-feira, 7 de novembro de 2013
HORA DE ESTUDAR : MODELOS ATÔMICOS PARTE II
AGORA VAMOS TESTAR SEUS CONHECIMENTOS:
01. PUC-RS
O átomo, na visão de Thomson, é constituído de:
a) níveis e subníveis de energia.
b) cargas positivas e negativas.
c) núcleo e eletrosfera.
d) grandes espaços vazios.
e) orbitais.
O átomo, na visão de Thomson, é constituído de:
a) níveis e subníveis de energia.
b) cargas positivas e negativas.
c) núcleo e eletrosfera.
d) grandes espaços vazios.
e) orbitais.
RESPOSTA:
Resposta: B
O átomo possui cargas (prótons e elétrons).
O átomo possui cargas (prótons e elétrons).
02. UFMG
Os diversos modelos para o átomo diferem quanto às suas potencialidades para explicar fenômenos e resultados experimentais.
Em todas as alternativas, o modelo atômico está corretamente associado a um resultado experimental que ele pode explicar, exceto em:
a) O modelo de Rutherford explica por que algumas partículas alfa não conseguem atravessar uma lâmina metálica fina e sofrem fortes desvios.
b) O modelo de Thomson explica por que a dissolução de cloreto de sódio em água produz uma solução que conduz eletricidade.
c) O modelo de Dalton explica por que um gás, submetido a uma grande diferença de potencial elétrico, se torna condutor de eletricidade.
d) O modelo de Dalton explica por que a proporção em massa dos elementos de um composto é definida.
RESPOSTA: C
O modelo de Dalton não relaciona o átomo com a carga elétrica.
O modelo de Dalton não relaciona o átomo com a carga elétrica.
03. UFSC
Na famosa experiência de Rutherford, no início do século XX, com a lâmina de ouro, assinale a(s) alternativa(s) que contém o(s) fato(s) que (isoladamente ou em conjunto) indicava(m) que o átomo possuía um núcleo pequeno e positivo.
01. As partículas alfa teriam cargas negativas.
02. Ao atravessar a lâmina, uma maioria de partículas alfa sofreria desvio de sua trajetória
04. Um grande número de partículas alfa não atravessaria a lâmina.
08. Um pequeno número de partículas alfa atravessando a lâmina sofreria desvio de sua trajetória.
16. A maioria das partículas alfa atravessaria os átomos da lâmina sem sofrer desvio de sua trajetória.
RESPOSTA :
01. Falso. A partícula alfa possui carga positiva.
02. Falso. Uma pequena quantidade sofre desvio de
trajetória.
trajetória.
04. Falso. O átomo é uma esfera oca.
08. Verdadeiro
16. Verdadeiro
quarta-feira, 6 de novembro de 2013
terça-feira, 5 de novembro de 2013
HORA DE ESTUDAR: EQUAÇÃO QUIMICA E BALACEAMENTO
AGORA VAMOS TESTAR SEUS CONHECIMENTOS :
Questão 1.
Considere as seguintes equações químicas:
1) 1 C12H22O11 → 12 C + 11 H2O
2) 1 KClO4 → 1 KCl + 2O2
3) 2 Fe + 3 H2SO4 → Fe2 (SO4)3 + 3 H2
4) NaHCO3 → Na2CO3 +CO2 +H2O
Pode-se afirmar que:
a) somente 1 e 2 estão balanceadas
b) 1, 2 e 3 estão balanceadas
c) todas estão balanceadas
Questão 2.
(PUC-RJ) O óxido de alumínio (Al2O3) é utilizado como antiácido. A reação que ocorre no estômago é:
X Al2O3 + Y HCl → Z AlCl3 + W H2O
Os coeficientes X, Y, Z e W são, respectivamente:
a) 1, 2, 3, 6.
b) 1, 6, 2, 3.
c) 2, 3, 1, 6.
d) 2, 4, 4, 3.
e) 4, 2, 1, 6.
Questão 3.
O airbag é um dispositivo destinado a proteger motoristas e passageiros em caso de colisão (batida).
A reação que ocorre dentro dos airbags é representada pela equação:
6 NaN3 (s) + Fe2O3 (s) → Na2O (s) + 2 Fe (s) +N2↑ (g)
Após o balanceamento da equação, a soma de todos os coeficientes mínimos e inteiros das espécies químicas envolvidas é igual a:
a) 16
b) 20
c) 22
d) 8
Questão 4.
Efetue o balanceamento das equações a seguir:
a) Mg (s) + O2 (g) → MgO (s)
b) CH4 (g) + O2 (g) → CO2 (g) + H2O (l)
c) C2H4 + O2 → CO2 + H2O
d) C2H6O + O2 → CO2 + H2O
Respostas.
Questão 1.
b) 1, 2 e 3 estão balanceadas.
Questão 2.
b) 1, 6, 2, 3.
Questão 3.
b) 20
Questão 4.
a) 2 Mg (s) + O2 (g) → 2MgO (s)
b) CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O (l)
c) 1 C2H4 + 3 O2 → 2 CO2 + 2 H2O
d) 1 C2H6O + 3 O2 → 2 CO2 + 3 H2O
segunda-feira, 4 de novembro de 2013
sábado, 2 de novembro de 2013
Assinar:
Postagens (Atom)



